Страница: 15/38
Если установлена структура всех полипептидов, полученных расщеплением исследуемого белка с помощью трипсина (далее такие полипептиды обозначаются буквой Т - от слова “трипсиновые”), то остается определить для каждого из этих пептидов, с какими двумя Т-пептидами он соседствует с N- и С-конца. В структуре просеквенированных Т-пептидов такая информация полностью отсутствует. Однако ее можно частично, а в ряде случаев и полностью восстановить, если располагать аналогичными данными для серии полипептидов, полученных расщеплением того же исследуемого белка по какой-либо другой группе аминокислотных остатков. Для определенности ниже речь будет идти о полипептидах, полученных расщеплением химотрипсином (пептиды группы С, chymotryptic).
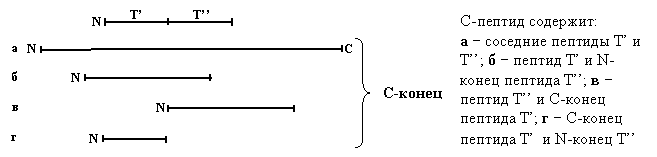
Как видно из рисунка, если два Т-пептида являются соседними в исходной цепи, то существует С-пептид, который либо содержит в своем составе полностью оба или один из рассматриваемых Т-пептидов, либо как минимум содержит С-концевую часть левого и N-концевую часть правого пептида группы Т. этот С-пептид перекрывает два соседних Т-пептида, с чем и связано название метода.
Таким образом, просматривая структуры пептидов Т и С, можно для любой пары Т-пептидов выявить, являются ли они соседями в исследуемом белке или разделены одним или несколькими другими Т-пептидами. Неоднозначность может появиться только в том случае, если перекрываемый каким-либо из С-петидов концевой фрагмент встречается у двух или нескольких Т-пептидов. Вероятность этого как правило невелика. Если это все же происходит, то применяют более сложные методы комбинаторики.
7.2. Методы зонального разделения
Эти методы основаны на том, что создается некоторая система, в которой компоненты смеси перемещаются с различными скоростями. Если в такую систему ввести разделяемую смесь в виде некоторой зоны, то по мере ее перемещения компоненты смеси, движущиеся с разными скоростями, будут формировать отдельные зоны, которые затем можно разнести в разные приемники.
1) Хроматография. При разделении белков и их анализе используется жидкостная хроматография. В жидкостной хроматографии зона разделяемых веществ с помощью тока элюирующей (вымывающей) жидкости перемещается относительно неподвижной фазы, которая обладает разным сродством к разделяемым компонентам. При перемещении зоны с помощью тока элюента каждый из разделяемых компонентов проводит некоторую часть времени на неподвижной фазе. Чем больше это время, тем медленнее перемещается зона с разделяемой смесью.
В зависимости от природы физико-химического явления, лежащего в основе разделения веществ, различают адсорбционную, ионообменную, распределительную и гель-хроматографию (эксклюзивную хроматографию). В адсорбционной чаще всего используют оксид алюминия в качестве неподвижной фазы. В ионообменной используются те же типы ионитов, что в ионообменной сорбции. Распределительная хроматогрфия основана на разделении веществ между двумя несмешивающимися жидкими фазами. Неподвижная жидкая фаза образуется в результате ее закрепления на пористом нерастворимом носителе. В гель
2) Электрофорез. В этом случае зоны создаются в результате того, что разные компоненты смеси с различной скоростью перемещаются в электрическом поле. После специальной обработки разделяемые смеси наносят на гель (декстроновый, полиакриламидный, или другой) а затем подключают но определенное время постоянный электрический ток. Белки в зависимости от своей молекулярной массы и заряда начинают двигаться с различной скоростью. После отключения тока гель помещают в специальный раствор, где интересующие исследователя белки окрашиваются. Существует электрофорез в растворе, но он имеет ограниченное применение, т.к. исследуемые белки часто подвергаются значительному диффузионному размыванию. Однако сейчас стало возможным применять этот метод в условиях невесомости в космосе, что устраняет конвекционные токи, обуславливающие диффузионную размывку.
Реферат опубликован: 3/06/2006