Страница: 2/3
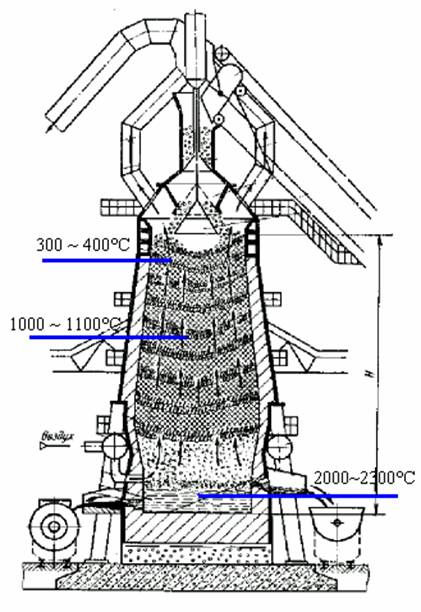
Реакция горения углерода кокса.
C + O2 ® CO2 + Q1
CO2 + C ® 2CO - Q2
Уравнение восстановления железа в доменной печи.
3Fe2O3 + CO2 ® 3Fe3O4 + CO2 + Q3
Fe3O4 + CO ®3FeO + CO2 – Q4
FeO + CO ® Fe + CO2 + Q5
Продукты доменной печи.
Чугун – основной продукт доменной печи
Литейный чугун – применяется на машиностроительных предприятиях для производства фасонных отливок.
Передельный чугун предназначен для переплавки в сталь в конвертерах или мартеновских печах.
Доменные ферросплавы – сплавы железа с кремнием, марганцем и другими элементами. Применяются для раскаления и легирования сталей.
Побочные продукты – шлак и доменный газ. Из шлака изготавливают цемент, шлаковату. Доменный газ применяют как топливо для подогрева воздуха, подаваемого в доменную печь.
Определение стали.
Сталь – сплав Fe с C ([С] < 2.5%)
Высококачественная сталь ([С] < 0,6~0,7%).
Сущность металлургического процесса передела чугуна в сталь.
Сущность процесса переплавки чугуна в сталь заключается в снижении концентрации углерода и удаления вредных примесей, путем избирательного их окисления и перехода в шлак или газ.
Граница раздела шлак – сталь.
Граница обеспечивается тем, что расплавленный металл и шлак имеют разную плотность и нерастворимы друг в друге.
Основные этапы переплава чугуна в сталь.
Первый этап: Расплавление шихты и нагрев металла. Окисление железа. Удаление фосфора. Для более полного удаления фосфора в расплавленный металл добавляют шлак, содержащий CaO. Из-за нехватки FeO добавляют в металл руду или окалину (в виде шлака).
Второй этап: кипение металлической ванны, восстановление Fe из FeO с выделением углекислого газа. Вместе с всплывающими пузырьками поднимаются прилипшие к ним примеси (флотация). Удаление серы из металла в шлак. Чем выше температура, тем активнее удаляется сера.
Третий этап: раскисление стали (восстановление Fe из FeO).
Химическая реакция окисления железа при переплавке чугуна в сталь.
2Fe + O2 ® 2FeO + 527.36 кДж/моль;
Протекание основных химических реакций и физико-химических явлений на этапе расплава шихты и нагрева расплавленного металла.
2FeO + Si ® SiO2 + Fe + 330 кДж/моль;
5FeO + 2P ® P2O5 + 5Fe + 226 кДж/моль
FeO + Mn = MnO + Fe + 123 кДж/моль.
Ангидрид фосфора – нестойкое соединение. Его вытесняют из расплавленного металла с помощью CaO:
2P + 5FeO + 4CaO 4CaO*P2O5 + 5Fe
При кипении металла происходят следующие реакции:
FeO + C = CO + Fe – 153.93 кДж/моль
FeS + CaO = CaS + FeO (в шлаке)
FeS + CaO = CaS + FeO (на границе раздела металл – шлак).
Сущность раскисления стали, два основных способа раскисления.
Сущность раскисления заключается в восстановлении оксида железа, растворенного в жидком металле. Раскисление можно проводить двумя способами:
Осаждающим. Осуществляется введением в жидкую сталь растворимых раскислителей (ферромарганца, ферросилиция, алюминия). В результате раскисления восстанавливается железо, и образуются оксиды марганца, алюминия и кремния, обладающие меньшей плотностью, нежели сталь, удаляющиеся в шлак. Однако часть их может остаться в стали, что понижает её свойства.
Диффузионным. Осуществляется раскислением шлака. Ферромарганец, ферросилиций, ферроалюминий мелкоизмельченными загружают на поверхность шлака. Раскислители, восстанавливая оксид железа, уменьшают его содержание в шлаке. В соответствии с законом распределения оксид железа, растворенный в стали, начнет переходить в шлак. Оксиды остаются в шлаке, а восстановленное железо переходит в сталь, что уменьшает содержание в ней неметаллических примесей и тем самым повышая её свойства.
Стали, получаемые в процессе раскисления.
Спокойная сталь получается при полном раскислении в печи или ковше.
Кипящая сталь получается при неполном раскислении. Её раскисление продолжается при остывании слитка. CO выделяется из стали, способствуя удалению из неё водорода и азота, в виде пузырьков, вызывая её «кипение».
FeO + C = Fe + CO.
Полуспокойная сталь. Сталь, раскисление которой протекает в печи и в процессе остывания слитка.
Реферат опубликован: 22/07/2006